国内药讯
1.关于加快推进门诊费用跨省直接结算工作的通知
2021-05-06 发布单位:医保局
2021年底前,各省份60%以上的县至少有1家普通门诊费用跨省联网医疗机构,各统筹地区基本实现普通门诊费用跨省直接结算;对于高血压、糖尿病、恶性肿瘤门诊放化疗、尿毒症透析、器官移植术后抗排异治疗等5个群众需求大、各地普遍开展的门诊慢特病,每个省份至少有一个统筹地区实现相关治疗费用跨省直接结算。
2.关于适用《M9:基于生物药剂学分类系统的生物等效性豁免》及问答文件和《Q5D:用于生物技术产品及生物制品生产的细胞基质的来源和鉴定》国际人用药品注册技术协调会指导原则的公告
2021-05-07 发布单位:NMPA
申请人需在现行技术要求基础上,尽早按照ICH指导原则的要求开展研究。本公告发布之日起6个月后开始的相关研究(以试验记录时间点为准),适用上述ICH指导原则。
3.关于开展第五批国家组织药品集中采购相关药品信息收集工作的通知
2021-05-08 发布单位:上海阳光采购网
自2021年5月10日起,符合国家集采申报条件的企业,须提交代表机构或企业法人的证明材料。符合药品要求的证明材料(包括药品注册批件、补充注册批件、说明书等)。产能及原料药自产说明等。
4.关于建立完善国家医保谈判药品“双通道”管理机制的指导意见
2021-05-10 发布单位:医保局
为破解部分谈判药品出现“进院难”现象(新药临床需求周期、医院配备药品数、药品配备成本等因素),制定指导意见。“双通道”是指通过定点医疗机构和定点零售药店两个渠道,满足谈判药品供应保障、临床使用等方面的合理需求,并同步纳入医保支付的机制。发挥定点零售药店分布广泛、市场化程度高、服务灵活的优势,与定点医疗机构互为补充,形成供应保障合力。鼓励具备条件的定点医药机构开展预约就诊、送药上门等服务。稳妥推进将“双通道”谈判药品纳入异地就医直接结算范围。
5.关于全面加强药品监管能力建设的实施意见
2021-05-10 发布单位:国务院办公厅
落实“四个最严”要求:最严谨的标准、最严格的监管、最严厉的处罚、最严肃的问责
优化中药审评机制。遵循中药研制规律,建立中医药理论、人用经验、临床试验相结合的中药特色审评证据体系,重视循证医学应用,探索开展药品真实世界证据研究;
建设国家药物警戒体系。加强药品、医疗器械和化妆品不良反应(事件)监测体系建设和省、市、县级药品不良反应监测机构能力建设。制定药物警戒质量管理规范,完善信息系统,加强信息共享;
完善信息化追溯体系,从疫苗、血液制品、特殊药品等开始,逐步实现药品来源可查、去向可追;
推进全生命周期数字化管理。加强政府部门和行业组织、企业、第三方平台等有关数据开发利用,研究探索基于大数据的关键共性技术与应用。
6.关于印发儿童血液病、恶性肿瘤相关12个病种诊疗规范(2021年版)的通知
2021-05-13 发布单位:医政医管局
1.儿童脑胶质瘤诊疗规范(2021年版)
2.儿童髓母细胞瘤诊疗规范(2021年版)
3.儿童颅咽管瘤诊疗规范(2021年版)
4.儿童室管膜肿瘤诊疗规范(2021年版)
5-1.儿童中枢神经系统生殖细胞肿瘤诊疗规范(2021年版)
5-2.儿童颅外恶性生殖细胞肿瘤诊疗规范(2021年版)
6.儿童及青少年鼻咽癌诊疗规范(2021年版)
7.儿童甲状腺癌诊疗规范(2021年版)
8.儿童胸膜肺母细胞瘤诊疗规范(2021年版)
9.儿童及青少年神经纤维瘤病诊疗规范(2021年版)
10.儿童慢性活动性EB病毒感染诊疗规范(2021年版)
11.儿童朗格罕细胞组织细胞增生症诊疗规范(2021年版)
12.儿童自身免疫性溶血性贫血诊疗规范(2021年版)。
7.关于发布《药物警戒质量管理规范》的公告
2021-05-13 发布单位:NMPA
2020年12月7日发布征求意见稿。正式稿发布自2021年12月1日起正式施行。
本规范适用于药品上市许可持有人(以下简称“持有人”)和获准开展药物临床试验的药品注册申请人(以下简称“申办者”)开展的药物警戒活动。
8.公开征求《急性非静脉曲张性上消化道出血治疗药物临床试验技术指导原则》意见的通知
2021-05-14 发布单位:CDE
为进一步规范和指导急性非静脉曲张性上消化道出血治疗药物临床试验,提供可参考的技术规范,起草此指导原则。主要针对用于治疗胃或十二指肠溃疡等引起的上消化道出血, 治疗其他原因如急性胃粘膜病变等引起的急性非静脉曲张性上消化道出血也可参考使用。 本指导原则适用于化学药品和治疗用生物制品的药物研发,仅作为推荐性建议。
9.关于公开征求《化学药品和治疗用生物制品说明书中儿童用药相关信息撰写的技术指导原则(征求意见稿)》意见的通知
2021-05-14 发布单位:CDE
药品说明书中儿童用药信息缺失或表意不明确是导致儿科不规范处方行为和不合理用药引发儿童用药安全有效性问题的重要原因之一。为促进企业有序开展起草和完善药品说明书中儿童用药信息的相关工作,,起草此指导原则。
10.关于发布《化学仿制药参比制剂目录(第四十三批)》的公示
2021-05-17 发布单位:CDE
共公示参比制剂40种(含增补),未通过审议品种44种。
11.关于药品专利纠纷早期解决机制相关专利信息登记平台公开测试等有关事宜的通知
2021-05-18 发布单位:CDE
搭建中国上市药品专利信息登记平台,并附填表说明、专利声明公开模板。公开测试征求意见。测试地址:https://zldj.cde.org.cn。
12.关于发布《化学仿制药参比制剂目录(第四十四批)》的公示
2021-05-21 发布单位:CDE
共公示参比制剂59种(含增补),未通过审议品种30种。
国际药讯
13.FDA 仿制药综合生产评价、无菌保证以及上市后药物警戒要点
2021-05-06 发布单位:识林
今天我们来看看美国 FDA 2021 仿制药论坛上有关生物药剂学风险评价、综合生产评价(integrated manufacturing assessment)、无菌保证以及仿制药上市后药物警戒方面的讨论。
药品质量办公室(OPQ)生物药剂学处代理生物药剂学主管 Min Li 讨论了生物药剂学风险评价用于指导固体口服制剂的溶出方法开发。报告介绍了对生物药剂学风险评价目的的理解,并讨论了如何进行评价,其重点是理解体外溶出度测试对 BA/BE 风险降低的作用。
OPQ 药品生产评价办公室的 Vidya Pai 介绍了对综合生产评价的监管期望。报告还讨论了需要关注对于来自生产审评团队的缺陷和问题的回应。报告的主要目的是让企业知道他们需要了解审评团队问的问题并提供相关、完整、简洁和准确的答复来解决 FDA 提出的问题。她在报告中举了一些缺陷例子和在回复时的考虑要点,通过这些例子可以更好地了解 FDA 在提出缺陷时背后的监管期望是什么。她重点指出:
● 普遍的缺陷是可解决的,需要适当注意细节并包含由科学和基于风险的分析支持的信息和论证。
● 存在澄清和与 FDA 讨论的途径(例如,针对复杂 ANDA 审评问题的中期电话会)。
● 提交的文件应表明对产品、工艺和实施风险有透彻的了解,从而可以进行可靠的产品质量管理。
OPQ 药品生产评价办公室微生物评价处处长 Marla Stevens-Riley 在构建更好的无菌保证申请中着重介绍了 OGD 在无菌保证申报资料中发现的一些常见问题。明确和简洁是关键,同时要确保无菌保证申报或 DMF 的不同部分之间没有差异。常见问题包括:
● 冲突信息 — 例如,在不同模块提到不同的设备或者叙述不一致
● 缺乏理论依据或合理性 — 例如,验证应支持商业生产
● 不包含有关接收到的无菌或去热原的物品信息
● 在高压釜中未发现灭菌过滤器
● 未描述生物负荷监测
● 生物负荷监测位置不充分 — 例如,应在任何过滤之前进行监测
● 没有压力和真空条件被用于容器密封系统完整性测试
● 对于生物指示剂来说不可接受的培养条件
● 培养基灌装不能代表最大生产状态
● 不正确地使用合并内毒素检测
● 用于产品放行的不正确内毒素限度
仿制药的上市后安全性和药物警戒通常来说并不重要,因为仿制药的概况与品牌药非常相似,但是如临床安全监督主管 Howard Chazin 所介绍,首仿药在质量属性方面可能会有差异,尤其是对于药械组合产品来说。过去有关质量问题的一些经验包括:
● 药片破裂
● 刻痕药品切分不均匀或碎裂
● 药片粘喉
● 异常气味、味道或质地
● 口服液和注射剂中有沉淀
● 贴剂不粘肤
● 容器/密封问题
● 滴眼液安全密封条脱落
● 大尺寸药片/胶囊
● 缓释产品无法维持一整天
● 注射器故障/断针
在新仿制药进入市场后,主动药物警戒可以检测是否存在问题。Chazin 提供了一些例子来说明主动药物警戒可以在哪些方面提前通知是没有潜在质量安全问题还是有重大问题。在干粉吸入器方面存在细微差别的 Advair 和仿制 Wixela Inhub 在初步监测后未显示质量或安全性问题。而用于多发性硬化症的 Copaxone 自动注射器与仿制产品之间允许的差异则导致,相对于品牌产品,仿制产品的自动注射器针头弯曲或折断的问题更常见。此问题正在调查中。
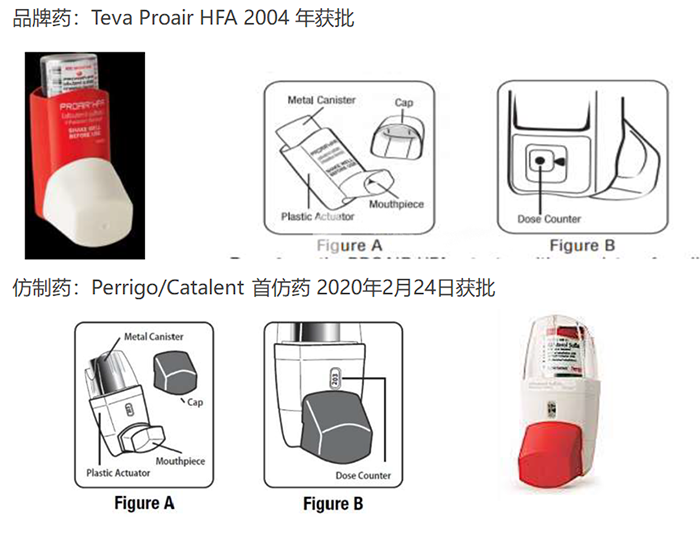
Proair HFA 沙丁胺醇吸入器是 Teva 的品牌产品,Perrigo/Catalent 的仿制产品在 2020 年 2 月 24 日获批,仿制产品与品牌产品之间存在允许的差异。批准后仿制产品出现非预期安全性信号,开始有吸入器堵塞的报告。2020 年 8 月 , 仿制药商和分销商停止生产和分销,并发起自愿召回 , 现在正在调查堵塞问题。
Chazin 强调:
● 仿制药与品牌药一样安全有效
● 在极少数情况下允许的差异可能会导致非预期或意向外的质量或安全性问题
● 复杂仿制药械组合产品由于药物递送、器械组成部分的差异以及可能需要立即采取行动的意向外质量问题而引发独特的潜在安全问题
● 与增加仿制药市场份额有关的提前考虑有助于帮助重点关注仿制药的药物警戒工作
● 跨 CDER 的内部对话可帮助员工参与、支持研究并促进公众沟通
● 与仿制药利益相关者的联络是完善 OGD 正在进行的安全性监督流程和程序的关键